更新时间:2026-01-30 15:46:48点击:来源:康婷健康解码
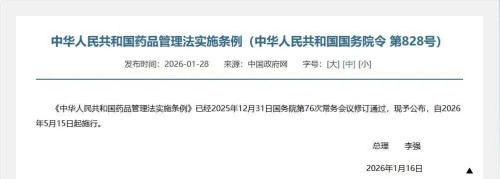
2026年开年,生物医药行业迎来重磅法令——1月16日李强总理签署的第828号国务院令(《中华人民共和国药品管理法实施条例》)发布,将于5月15日正式施行;而早在2025年9月落地的第818号国务院令(《生物医学新技术临床研究和临床转化应用管理条例》),也将在今年5月1日同步生效。这两份文件一“药”一“术”,终于拼齐了中国生物医药产业的顶层监管拼图,“模糊试探”的时代彻底终结,“合规竞速”的赛道正式开启。
一、双令分工:818 管 “术”、828 管 “药”,边界清晰
很多从业者会疑惑,为何国家要接连出台两部法规?答案藏在“双轨制” 的精准定位里 —— 前者划清医院端 “技术施治” 的边界,后者筑牢企业端 “药品上市” 的根基。
01.回顾818号令:给医院里的“生物医学新技术”立规矩
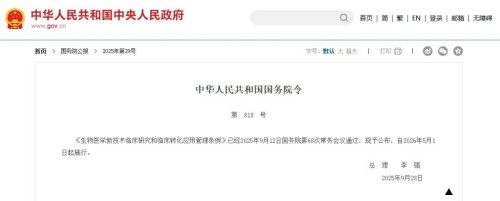
作为管“术”的核心法规,818号令聚焦医院内的新技术应用,从研究到转化搭建了完整闭环:
•门槛先卡死:能开展临床研究的机构,必须是三甲医院,还得有合格的学术委员会、伦理委员会,以及匹配的场地、人员和经费,非三甲医院直接被排除在外;
•流程严把控:新技术要先过“非临床研究(实验室+动物实验)→学术审查→伦理审查→备案”四关,备案后国务院卫健委还会动态评估,发现重大风险直接叫停;
•红线不能碰:严禁技术外包,所有操作必须在医院内完成,且不能向受试者收取任何研究相关费用,从源头杜绝“院外灰色治疗”。
这份法规的信号很明确:国家承认医疗技术的创新价值,但必须把它装在“安全合规”的笼子里,让患者在三甲医院里放心享受到技术红利。
02.新发828号令:给药企的“活体药物”定乾坤
如果说818号令是“医院指南”,828号令就是“药企手册”,尤其针对CAR-T、干细胞等“活体药物”,给出了清晰的商业化路径:
•MAH制度“紧箍咒”升级:以前药企能当“甩手掌柜”,研发完委托生产就不管了,现在上市许可持有人(MAH)要对药品全生命周期负责,连找CMO代工厂都得先证明自己的质量管理能力(QMS),没实力的企业连代工资格都拿不到。
•附条件批准成“快车道”:针对晚期癌症等无有效治疗手段的疾病,企业不用等三期临床做完,只要二期数据够硬就能提前上市卖药——但利好背后有风险,上市后必须补做临床,做不出来就撤销批文,彻底堵死“PPT造药”的路。
•真实世界数据(RWE)获法定地位:这是最让企业兴奋的突破!过去医院里的IIT研究数据,药监局大多不认,现在只要数据真实、完整、可溯源,符合《真实世界证据支持药物研发与审评的指导原则》,就能直接用于药品注册(IND/NDA),相当于打通了“低成本试错→高估值上市”的商业闭环。
二、行业变局:灰色地带进入倒计时,合规成生存底线
把818号令和828号令放在一起看,国家的“清场+加速”意图再明显不过:要把所有“救命的创新”都纳入合规池,不符合的直接淘汰。
哪些机构要警惕?就是那些“两头不靠”的企业——既拿不到828号要求的国药准字,又进不了818号限定的三甲医院,搞“干细胞回输”、“私人定制细胞治疗”的机构等。随着5月15日828号令将正式施行,这些灰色地带的生存空间将被彻底挤压,倒计时已经正式开始。
而合规企业将迎来红利:真正有临床价值的创新药,审批速度会更快;能在三甲医院落地的新技术,能合法开展收费转化。行业将从“野蛮生长”转向“精耕细作”,“合规”不再是加分项,而是活下去的前提。
三、留给企业调整的窗口期只剩不到4个月,该如何应对?
1.补齐合规短板,筑牢数据安全防线
828号令对数据造假的处罚力度堪称“史上最严”,违规行为不仅将面临顶格罚款,相关主体还将被实施行业禁入,直接断送企业发展前路。当前,企业需将数据合规提升至战略高度,立即搭建符合ALCOA+C原则(可追溯、清晰、同步、原始、准确、完整)的数据管理体系,这一工作的优先级远超单纯扩充销售团队——数据不合规,即便拥有优质的技术与产品,也无法通过监管审核,更难以实现长远发展。
2.锚定临床价值:解决真问题才是王道
无论选择818技术线还是828药品线,“临床价值”都是贯穿监管与市场的核心通行证。那些“拥有技术优势,但未明确临床适应症、无法解决真实医疗痛点”的企业,终将被监管政策与市场规律双重淘汰。唯有聚焦未被满足的临床需求,以解决真实医疗问题为根本,才能顺利穿越监管调整周期,在行业洗牌中站稳脚跟、实现长效发展。
四、康婷集团:深耕研发,勇担攻克疾病使命
早在国务院818号令发布前,康婷集团已开始在生物新技术的合规化申报和管理方面进行布局,选择深耕10余年的干细胞技术,以及新冠后主要高发后遗症——特发性肺纤维化(IPF)作为适应症,计划将编号为KT-001的人脐带间充质干细胞(hUC-MSCs)注射液作为康婷首个活体药物推出。目前,KT-001的IND申报项目正在稳步推进中,药学阶段开发工作如期进行,且已提前进入非临床研究阶段,其中药效学预实验结果符合预期,有望早于原计划完成注册工作。而相关政策的适时落地,无疑成为康婷集团在生物创新药物发展道路上的强劲助力和有力依托。

作为深耕大健康产业多年的创新型企业,康婷集团拥有着雄厚的科研实力、坚定的社会责任担当以及敏锐的行业洞察力,让集团的各类技术创新始终行走在合规且可靠的轨道上。IND项目的启动,体现了康婷整体规划的前瞻性,也是集团在细胞治疗领域硬实力最为有力的展示,对康婷大健康产业具有里程碑式的意义。我们始终秉持着:
•高标准筑牢合规根基:始终以超行业标准构建全生命周期可溯源质量管理体系,坚守合规底线,为行业规范化发展提供可借鉴范本;
•全链条严控产品质量:依托GMP标准厂房,从供者筛选到细胞分离、扩增、储存,每一个关键环节从严把控,同时加强与行政主管部门深度交流,确保申报资料合规无误;
•深解析突破技术核心:聚焦hUC-MSCs治疗IPF的分子机制与细胞信号通路,锁定关键调控节点,实现从“对症治疗”到“对因治疗”的跨越,让治疗更具针对性;
•多维度验证药物疗效:搭建大鼠、小鼠及灵长类多模型IPF评估平台,系统开展药物代谢动力学、毒理学研究,全面评估药物安全性与有效性,为临床应用提供坚实数据支撑。

面对攻克疾病难题,康婷集团未来将持续加码细胞治疗方向的研发投入,继续坚持以技术创新驱动产品优化升级。我们有理由相信,康婷集团在国家政策引领下,在合规可持续发展的赛道上必会取得喜人成果,为一众患者带来福音。
五、结语
十余年布局沉淀,终迎来厚积薄发。康婷集团在双重号令发布前的前瞻性布局,是其IND项目稳步推进的底气;而严谨的科研态度、创新的合作模式、严格的质量管控,更是项目成功的保障。未来,康婷将持续深耕生物医药领域,助力“健康中国”战略稳步前行。
